软硬酸硷理论:将酸和硷根据性质的不同各分为软硬两类的理论。
在1963年,由卞江与张祖德提出。
基本介绍
- 中文名:软硬酸硷理论
- 外文名:Hard-Soft-Acid-Base
- 概念:体积小,正电荷数高
- 理论原理:电荷密度与粒子半径的比值较大
简介
软硬酸硷理论简称HSAB(Hard-Soft-Acid-Base)理论,是一种尝试解释酸硷反应及其性质的现代理论。它目前在化学研究中得到了广泛的套用,其中最重要的莫过于对配合物稳定性的判别和其反应机理的解释。软硬酸硷理论的基础是酸硷电子论,即以电子对得失作为判定酸、硷的标準。
理论
将酸和硷根据性质的不同各分为软硬两类的理论。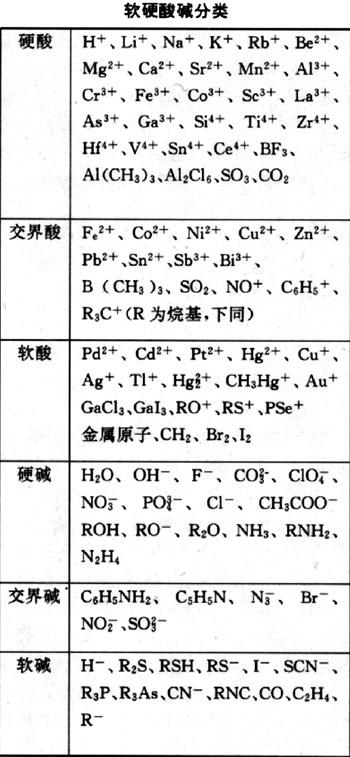

the theory of hard and soft acids and bases
概念:体积小,正电荷数高,可极化性低的中心原子称作硬酸,体积大,正电荷数低,可极化性高的中心原子称作软酸。将电负性高,极化性低难被氧化的配位原子称为硬硷,反之为软硷。硬酸和硬硷以库侖力作为主要的作用力;软酸和软硷以共价键力作为主要的相互作用力。
理论原理
在软硬酸硷理论中,酸、硷被分别归为“硬”、“软”两种。“硬”是指那些具有较高电荷密度、较小半径的粒子(离子、原子、分子),即电荷密度与粒子半径的比值较大。“软”是指那些具有较低电荷密度和较大半径的粒子。“硬”粒子的极化性较低,但极性较大;“软”粒子的极化性较高,但极性较小。 此理论的中心主旨是,在所有其他因素相同时,“软”的酸与“软”的硷反应较快速,形成较强键结;而“硬”的酸与“硬”的硷反应较快速,形成较强键结。 大体上来说,“硬亲硬,软亲软”生成的化合物较稳定。
分类
将酸和硷根据性质不同分为软硬两类的理论。1963年由R.G. 皮尔孙提出。1958 年 S.阿尔兰德、J.查特和N.R.戴维斯根据某些配位原子易与 Ag+、Hg2+、Pt2+ 配位;另一些则易与Al3+、Ti4+配位,将金属离子分为两类。 软硬酸硷理论
软硬酸硷理论
 软硬酸硷理论
软硬酸硷理论a类金属离子包括硷金属 、硷土金属、Ti4+、Fe3+、Cr3+、H+;
b 类金属离子包括Cu+、Ag+、Hg2+、Pt2+。皮尔孙在前人工作的基础上提出以软硬酸硷来区分金属离子和配位原子:
硬酸包括a类金属离子(硷金属、硷土金属、Ti、Fe、Cr、H)
硬硷包括F-、OH-、H2O、NH3、O2-、CH3COO-、PO43-、SO42-、CO32-、ClO4-、NO3-、ROH等
软酸 包括b类金属离子Cu+、Ag+、Hg2+、Pt2+、Au+;
Cd2+; Pd2+、Hg2+及MO等 软硬酸硷理论
软硬酸硷理论
 软硬酸硷理论
软硬酸硷理论软硷包括I-、SCN-、CN-、CO、H-、S2O32-、C2H4、RS-、S2-等
交界酸 包括Fe2+、Co2+、Ni2+; Zn2+、Pb2+、Sn2+、Sb3+、Cr2+、Bi3+ 、Cu2+等,
交界硷 包括N3-、Br- 、NO2-、N2 、SO32-等
表:软硬酸硷分类
反应规律
“硬酸优先与硬硷结合,软酸优先与软硷结合。” 软硬酸硷理论
软硬酸硷理论
 软硬酸硷理论
软硬酸硷理论这虽然是一条经验规律,但套用颇广:
①取代反应都倾向于形成硬 - 硬、软 - 软的化合物。
②软-软、硬-硬化合物较为稳定,软 - 硬化合物不够稳定。
③硬溶剂优先溶解硬溶质,软溶剂优先溶解软溶质,许多有机化合物不易溶于水 ,就是因为水是硬硷。
④ 解释催化作用。有机反应中的弗里德-克雷夫茨反应以无水氯化铝(AlCl3)做催化剂,AlCl3是硬酸,与RCl中的硬硷Cl-结合而活化。
————————————————————————————————————————————
用软硬酸硷理论解释为什幺AgCl不溶于水,而AgF溶于水 :
卤化银中,Ag+是软酸,与Cl-(交界硷)、Br-、I-(软硷)键合较水强,这些盐溶解度就小;但Ag+与F-(硬硷)键合较水弱,AgF溶解度就大。
用软硬酸硷理论如何解释硫酸中与羟基相连的S是硬酸还是软酸 :
1、中心S是+6价,正电荷越高,即硬酸。
2、硫酸是一种很稳定的酸,而硬硬结合或软软结合的产物一般都很稳定。
重要性
主要用于讨论金属离子的配合物体系;预言反应方向;预言配合物稳定性;合理解释Goldschmidt规则。
缺点:但是软硬酸硷理论也有局限,如软硷CN-和硬酸Fe3+和软酸Ag+都很容易反应.
简史
将酸和硷根据性质的不同各分为软硬两类的理论。1963年由R.G.皮尔孙提出。本理论适用于说明多种化学现象,如酸硷反应、金属和配位体间的作用、配离子形成(见配位化学),共价键和离子键的形成等。
1958年S.阿尔兰德、J.查特和N.R.戴维斯根据某些配位原子易与Ag、Hg、Pt配位,而另一些配位原子易与Al、Ti等配位,将金属离子和配位原子分成a和b两类。 软硬酸硷理论
软硬酸硷理论
 软硬酸硷理论
软硬酸硷理论a类金属离子包括硷金属、硷土金属、高氧化数的轻过渡元素Ti、Fe、Cr和H;
b类金属离子包括较重的、低氧化数的过渡元素Cu、Ag、Hg、Pt。
a类金属离子的特性随氧化数升高而加强,它优先与体积小、电负性大的原子结合;
b类金属离子形成化合物的稳定性,因配位原子的电负性增大而减弱:C≈S>I>Br>Cl>N>O>F
此顺序几乎(不是全部)和 a类金属离子形成化合物的稳定性顺序相反(见表),如与水相比,硫醚R2S (R为烷基)与b类金属离子Hg、Pt、Pd等配位倾向较强。这个经验性总结有助于判断配位化合物的稳定性。
皮尔孙在前人工作的基础上提出以软硬酸硷来区分a类和b类金属离子和配位原子。硬酸包括 a类金属离子,硬硷包括H2O、F等;软酸包括b类金属离子,软硷包括H、I等;交界酸包括 Fe、Cu,交界硷包括NO娱、SO娫 等(表1)。 皮尔孙提出酸硷反应的规律为:硬酸优先与硬硷结合,软酸优先与软硷结合。这是一个很有用的经验规则。
化学反应
软硬酸硷理论可说明多种化学现象。
取代反应
酸硷取代作用倾向于形成硬-硬、软-软化合物:HI(g)+F(g)→HF(g)+I(g) ΔH=-263.6kJ/mol
式中g为气态。H是硬酸,优先与硬硷F结合,反应放热。
双取代反应也倾向于生成硬-硬、软-软化合物,反应放热,如Li、Be是硬酸(Be比Sr硬),F是硬硷,I是软硷,反应如下: LiI+CsF→LiF+CsI ΔH=-65.7kJ/mol
BeI2+SrF2→BeF2+SrI2 ΔH=-200.8kJ/mol
化合物的稳定性
软-软、硬-硬化合物较为稳定。如软酸Cu易与软硷CN生成稳定的配位化合物(简称配合物)Cu(CN)+,其稳定常数lgβ2=24,此值大于Cu与硬硷NH3配合物Cu(NH3)2+的稳定常数(lgβ2=10.8);又如软酸Cd与软硷CN的配合物Cd(CN)+的稳定常数lgβ4=18.9,大于Cd与硬硷NH3配合物Cd(NH3)的稳定常数(lgβ4=6.92);软硷I易与软酸I2、Ag形成稳定的I3-、AgI,而硬硷却不能形成稳定的I2F、AgF。
一般软-硬化合物不够稳定,如CH2F2易分解:2CH2F2(g)─→CH4(g)+CF4(g)
硬酸Mg、Ca、Sr、Ba、Al等在自然界的矿物都是与硬硷O、F、CO、SO等的化合物,而软酸Ag、Hg等主要是与软硷S等的化合物。
高氧化数金属的化合物都是氧化物和氟化物,属硬-硬化合物,如OsO4、Mn2O7、IF7、OsF6;而某些低氧化数的金属与软硷的化合物比较稳定,如Mn(CO)5Cl。
溶解度
物质的溶解也是溶质和溶剂间的酸硷反应。常用的硬硷溶剂水和氨,较易溶解硬酸-硬硷的化合物,如LiCl、MgSO4、KNO3…;而软硷溶剂如苯等,易溶解软酸Br2、I2。
软酸Ag与硬硷F的化合物易溶于水,而软酸Ag与软硷Br、I的化合物难溶。Ag与硬硷NH3配合物的稳定常数lgβ2=7.4。对软酸Ag来说,硷的软性减弱顺序是:硬溶剂优先溶解硬溶质,软溶剂优先溶解软溶质。许多有机化合物不易溶于水,就是因为水是硬硷。 软硬酸硷理论
软硬酸硷理论
 软硬酸硷理论
软硬酸硷理论金属的电极电势
M(s)→M(aq)+ne
式中s为固态;aq为水溶液。金属离子化倾向取决于三个过程的能量: M(s)→M(g) (升华)
M(g)→M(g)+ne (电离)
M(g)+ne→M(aq)+ne (水合)
式中g为气态。金属的升华、电离都是吸热过程,水合是放热过程。从能量角度看,反应的推动力是水合能。若M是硬酸,则较易与硬硷(水)结合,金属的电极电势偏高;若M是软酸,与水的结合力较弱,金属的电势相应偏低。对于软酸(如Ag),如加入软硷(如 Br等),因发生软-软结合,使金属的标準电极电势有所降低,如:在液氨溶剂中,由于NH3不如H2O强,使某些硬酸的电势有所升高,而有些软酸的电势有所降低(与在水中的电极电势比),如表。 软硬酸硷理论
软硬酸硷理论
 软硬酸硷理论
软硬酸硷理论异性双基配体的配位情况 常见到的异性双基配体(见配位化合物)有 SCN、SeCN、 OCN、CNO、CN、S2O3…等,它们与何种原子配位,也可以利用硬-硬、软-软结合规则来判断:Fe是硬酸,将与SCN中“硬端”——N原子结合成Fe(NCS)3,其他如表所示。
类聚作用 酸或硷的接受或给予原子的酸硷性受形成配合物时配位体软、硬性的影响。一般软配位体倾向于使酸、硷变软,而硬的配位体趋向于使硬性增强。如【CoF(NH3)5】比【CoI(NH3)5】稳定,因硬硷NH3加强了Co的硬性,使之更易与强硷F结合。反之,若用软硷CN代替硬硷NH3,加强了Co的软性,使 【Co(CN)5I】稳定,而【Co(CN)5F】则不能形成。
加合反应热效应 表2是水溶液中的几个酸硷反应实例,前六个都是硬酸-硬硷的结合,ΔH(焓变)的绝对值都不大,TΔS(T为温度;ΔS为熵变)是较大的正值,其正向反应的推动力是TΔS;软酸-软硷结合的ΔH为负值,TΔS也是较小的值。
在水溶液中,软酸-软硷、硬酸-硬硷类型的结合,其ΔH和TΔS值的差别与水合作用有关。H2O是硬性物,硬硷、硬酸原先都有强烈的水合作用,当硬酸和硬硷加合时,排挤出原先的水分子,使混乱度增高,即ΔS增大;而软酸、软硷原先的水合较弱,当较酸和软硷发生加合时,放热明显,愈软,放热愈多。例如,Hg是软酸,它与软硷CH3加合得CH3Hg,后者与软硷RS加合,放热更多。
催化反应
有机化学中的弗里德-克雷夫茨反应以无水氯化铝AlCl3作催化剂。AlCl3是硬酸,与RCl中的硬硷Cl结合而活化:R与苯核作用:硬酸H与AlCl3中的硬硷Cl结合:其他硬酸如SnCl4、FeCl3也有类似于AlCl3的作用。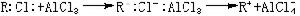 软硬酸硷理论
软硬酸硷理论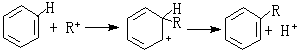 软硬酸硷理论
软硬酸硷理论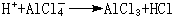 软硬酸硷理论
软硬酸硷理论
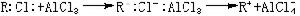 软硬酸硷理论
软硬酸硷理论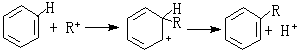 软硬酸硷理论
软硬酸硷理论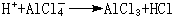 软硬酸硷理论
软硬酸硷理论金属催化剂中毒问题,也可从软硬酸硷规则来理解。一般零氧化数的金属都是软酸,易与软硷反应而中毒。如铁(软酸)催化剂,易与软硷如一氧化碳、硫、磷、砷等发生不可逆反应而引起铁中毒;硬硷如氧、水与铁发生可逆反应,不会引起铁中毒。
取代反应的速率
一般形成软酸-软硷化合物的反应速率较高。CH3Cl是软酸CH3和硬硷Cl的化合物,其中的CH3能与软硷RS、I、S2O3、R3P等发生较快的取代反应,而与硬硷RO、R3N、F、SO娸等的取代反应速率较低:CH3Cl+RS→CH3SR+Cl
CH3Cl+RO→CH3OR+Cl
前一个反应的速率是后者的100倍。
又如HI和AgF都是软-硬化合物。HI中的I(软硷)与Ag(软酸)发生快反应。同理,AgF 中的F(硬硷)与Al(硬酸)也发生快反应:HI+Ag→AgI+H
3AgF+Al→AlF3+3Ag
为了统一酸硷软硬标度,皮尔孙以H(质子)作为硬酸、CH3Hg(甲基汞离子)作为软酸的实验标準来测定它们与硷(B)反应的平衡常数,以决定硷的相对反应性能:硬酸H的参比平衡常数对数值lgK1的改变趋势与软酸CH3Hg的参比平衡常数对数值lgK1的改变趋势恰好相反(表3)。这表明:酸硷软硬标度既与硷本身的性质有关,也和与之结合的酸的特性有关。 同理,可用标準硬硷和标準软硷为参比,测定与酸的相对反应性质。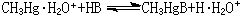 软硬酸硷理论
软硬酸硷理论
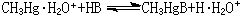 软硬酸硷理论
软硬酸硷理论参考书目
R.G.Pearson,Journal of Chemical Education,45,pp.581~587、643~648,1968.