MTT全称为3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,Thiazolyl Blue Tetrazolium Bromide,汉语化学名为 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,商品名:噻唑蓝,是一种黄颜色的染料。
基本介绍
- 中文名: 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐
- 外文名:mtt
- 分子式:C18H16BrN5S
- 分子量:414.32
化学物质
分子式
C18H16BrN5S
分子量
414.32
CAS号
298-93-1
MTT用途及原理
MTT主要有两个用途:
1.药物(也包括其他处理方式如放射线照射)对体外培养的细胞毒性的测定;
2.细胞增殖及细胞活性测定。
MTT原理:
检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲臜(Zā)(Formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚碸(DMSO)能溶解细胞中的甲臜(Zā),用酶标仪在490nm波长处(英文说明书写的是570nm)测定其光吸收值,在一定细胞数範围内,MTT结晶形成的量与细胞数成正比。根据测得的吸光度值(OD值),来判断活细胞数量,OD值越大,细胞活性越强(如果是测药物毒性,则表示药物毒性越小)。
实验方法
明确问题
1. 选择适当的细胞接种浓度。一般情况下,96孔培养板的一内贴壁细胞长满时约有105个细胞。但由于不同细胞贴壁后面积差异很大,因此,在进行MTT试验前,要进行预实验检测其贴壁率、倍增时间以及不同接种细胞数条件下的生长曲线,确定试验中每孔的接种细胞数和培养时间,以保证培养终止致细胞过满。这样,才能保证MTT结晶形成数量与细胞数呈的线性关係。否则细胞数太多敏感性降低,太少观察不到差异。
2. 药物浓度的设定。一定要多看文献,参考别人的结果再定个比较大的範围先初筛。根据自己初筛的结果缩小浓度和时间範围再细筛。切记!否则,可能你用的时间和浓度根本不是药物的有效浓度和时间。
3. 时间点的设定。在不同时间点的测定OD值,输入excel表,最后得到不同时间点的抑制率变化情况,画出变化的曲线,曲线什幺时候变得平坦了(到了平台期)那个时间点应该就是最好的时间点(因为这个时候的细胞增殖抑制表现的最明显)。
4. 培养时间。200ul的培养液对于10的4-5次方的增殖期细胞来说,很难维持68h,如果营养不够的话,细胞会由增殖期渐渐趋向G0期而趋于静止,影响结果,我们是在48h换液的。
5. MTT法只能测定细胞相对数和相对活力,不能测定细胞绝对数。做MTT时,儘量无菌操作,因为细菌也可以导致MTT比色OD值的升高。
6. 理论未必都是对的。要根据自己的实际情况调整。
7. 实验时应设定调零孔,对照孔,加药孔。调零孔加培养基、MTT、二甲基亚碸。对照孔和加药孔都要加细胞、培养液、MTT、二甲基亚碸,不同的是对照孔加溶解药物的介质,而加药组加入不同浓度的药物。
8. 避免血清干扰。用含15%胎牛血清培养液培养细胞时,高的血清物质会影响试验孔的光吸收值。由于试验本底增加,会试验敏感性。因此,一般选小于10%胎牛血清的培养液进行。在呈色后,儘量吸净培养孔内残余培养液。 mtt
mtt
 mtt
mtt步骤把握
MTT溶液的配製方法
通常,此法中的MTT浓度为5mg/ml。因此,可以称取MTT 0.5克,溶于100 ml的磷酸缓冲液(PBS)或无酚红的培养基中,用0.22μm滤膜过滤以除去溶液里的细菌,放4℃避光保存即可。在配製和保存的过程中,容器最好用铝箔纸包住。
需要注意的是,MTT法只能用来检测细胞相对数和相对活力,但不能测定细胞绝对数。在用酶标仪检测结果的时候,为了保证实验结果的线性,MTT 吸光度最好在0-0.7範围内。
MTT一般最好现用现配,过滤后4℃避光保存两周内有效,或配製成5mg/ml保存在-20度长期保存,避免反覆冻融,最好小剂量分装,用避光袋或是黑纸、锡箔纸包住避光以免分解。我一般都把MTT粉分装在EP管里,用的时候现配,直接往培养板中加,没必要一下子配那幺多,尤其当MTT变为灰绿色时就绝对不能再用了。
MTT有致癌性,用的时候小心,有条件最好带那种透明的簿膜手套,配成的MTT需要无菌,MTT对菌很敏感;往96孔板加时不避光也没有关係,毕竟时间较短,或者你不放心的时候可以把操作台上的照明灯关掉。
配製MTT时用用PBS溶解,也有人用生理盐水配,60℃水浴助溶。
PBS配方:
Nacl 8g
Kcl 0.2g
Na2HPO4 1.44g
KH2PO4 0.24g
调pH 7.4
定容1L
贴壁细胞
1. 收集对数期细胞,调整细胞悬液浓度,每孔加入100ul,铺板使待测细胞调密度至1000-10000孔,(边缘孔用无菌PBS填充)。
2. 5%CO2,37℃孵育,至细胞单层铺满孔底(96孔平底板),加入浓度梯度的药物,原则上,细胞贴壁后即可加药,或两小时,或半天时间,但我们常在前一天下午铺板,次日上午加药。一般5-7个梯度,每孔100ul,设3-5个复孔,建议设5个,否则难以反应真实情况。
3. 5%CO2,37℃孵育16-48小时,倒置显微镜下观察。
4. 每孔加入20ulMTT溶液(5mg/ml,即0.5%MTT),继续培养4h。若药物与MTT能够反应,可先离心后弃去培养液,小心用PBS沖2-3遍后,再加入含MTT的培养液。
5. 终止培养,小心吸去孔内培养液。
6. 每孔加入150ul二甲基亚碸,置摇床上低速振荡0.5min,使结晶物臜(Zā)充分溶解。在酶联免疫检测仪OD 560nm处测量各孔的吸光值。
7. 同时设定调零孔(培养基、MTT、二甲基亚碸),对照孔(细胞、相同浓度的药物溶解介质、培养液、MTT、二甲基亚碸)。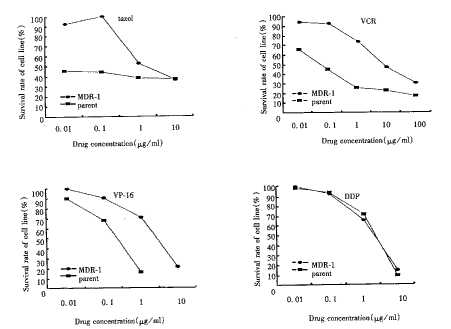 mtt
mtt
 mtt
mtt悬浮细胞
1. 收集对数期细胞,调节细胞悬液浓度1×106/ml,按次序将:①补足的1640(无血清)培养基40ul;②加Actinomycin D(有毒性)10ul用培养液稀释(储存液100mg/ml,需预试寻找最佳稀释度,1:10-1:20);③需检测物10ul;④细胞悬液50ul(即5×104cell/孔),共100ul加入到96孔板(边缘孔用无菌水填充)。每板设对照(加100ml 1640)。
2. 置37℃,5%CO2孵育16-48小时,倒置显微镜下观察。
3. 每孔加入10ul MTT溶液(5 mg/ml,即0.5%MTT),继续培养4h。(悬浮细胞推荐使用WST-1,培养4h后可跳过步骤4,直接酶联免疫检测仪OD 560nm(630nm校準)测量各孔的吸光值)。
4.离心(1000转x10min),小心吸掉上清,每孔加入100ul二甲基亚碸,置摇床上低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪OD 560nm(630nm校準)测量各孔的吸光值。
接种(铺板)
细胞过了30代以后就不要用了,因为状态不好了;培养板要用好的(最好进口板),不好的板或重複利用的板只可做预实验。
接种时最好按照预实验摸索出的密度接种,因为细胞密度在10000/ml左右时,所测得的OD值的区间即细胞抑制率(或者增值率)的所呈现的线性关係最好,结果最可信。如果铺的太稀细胞的杀伤不会很明显,太密细胞可能都会凋亡,因为细胞长的太快营养会不够,最后导致死亡。且而细胞过密或者过少,增殖都会过快或者过慢,其增值率线性关係不佳。故而MTT细胞密度多採用10000/ml,100ul/孔。
细胞密度要根据不同细胞的特点来定。如果你做的药品对细胞具有刺激作用那幺取小点的细胞浓度,如果你做的药品对细胞具有抑制作用那幺取大点的细胞浓度,这样与对照的区别更明显,数据更好。悬浮细胞每孔的细胞数可达到105,贴壁细胞可为103-104。
其它的声音
1. 首先细胞的接种密度一定不能过大,一般每孔1000个左右就够了,我认为宁少勿多。尤其是对于肿瘤细胞。10000/孔是太高了,这样即使药物有作用,MTT方法也是表现不出的,最佳点板浓度在4000-5000/孔,太少的话SD值会很大。(对于不同的细胞,每孔细胞数要摸索一下,对照组OD在1.4以下为佳,当然通常来说更不要超过2。)
2. MTT本身就是比较粗的实验,增殖率10%左右的波动都不算奇怪。特别是新手,20%的波动也是常见的,所以很可能是技术原因引起的,特别是种板技术一定要过关。
3. 我做的是肿瘤细胞的MTT实验,这种细胞长的很快一开始我是用100000/ML的浓度来接种的,结果细胞长的太满结果是没有梯度也没有线性关係。后来调整浓度,用过40000~80000/ML的浓度都做过MTT实验,结果发现做的结果比较好点的是60000~70000/ML的浓度组的。用40000/M的浓度的组,由于细胞少,药物作用的梯度还是有,只是没有很好的线性关係。还有根据细胞生长速度以及药物的特性(有时间依赖性和浓度依赖性的药物)来确定培养时间是48小时还是72小时。
注意细胞悬液一定要混匀,以避免细胞沉澱下来,导致每孔中的细胞数量不等,可以每接几个就要再混匀一下。加样器操作要熟练,儘量避免人为误差。虽然移液器比移液管精确得多,但是如果操作不熟,CV会在8%左右。另外,吹散次数过多也会影响细胞活力。所以要熟练些、快些上板。